

雷晓光团队与合作者阐明离子通道蛋白TRPV4小分子抑制剂的结构药理学基础
瞬时感受器电位香草酸受体4(Transient Receptor Potential Vanilloid 4,TRPV4)是瞬时受体电位离子通道家族的成员之一,属于非选择性阳离子通道。TRPV4广泛分布于大脑、心脏、肝脏、肺部、肾脏、胰腺、卵巢、骨组织以及皮肤表面,可以被机械刺激、低渗透压、温度等理化刺激激活。TRPV4在调节大脑对系统渗透压的功能中发挥作用,参与血管功能、肝脏、肠道、肾脏和膀胱功能、皮肤屏障功能、骨骼的生长和结构完整性、关节功能、气道和肺功能、视网膜和内耳功能,以及疼痛等多个方面。TRPV4基因突变与骨发育不良、早期骨关节炎和神经运动功能障碍等多种遗传性疾病相关,例如为人熟悉的苏格兰折耳猫中发生的TRPV4突变,表现为遗传性的苏格兰折耳猫软骨发育不良综合征(Scottish Fold Osteochondrodysplasia,SFOCD)。SFOCD影响前肢远端、后肢远端和尾部的形态,导致软骨纤维化和关节逐渐受损。
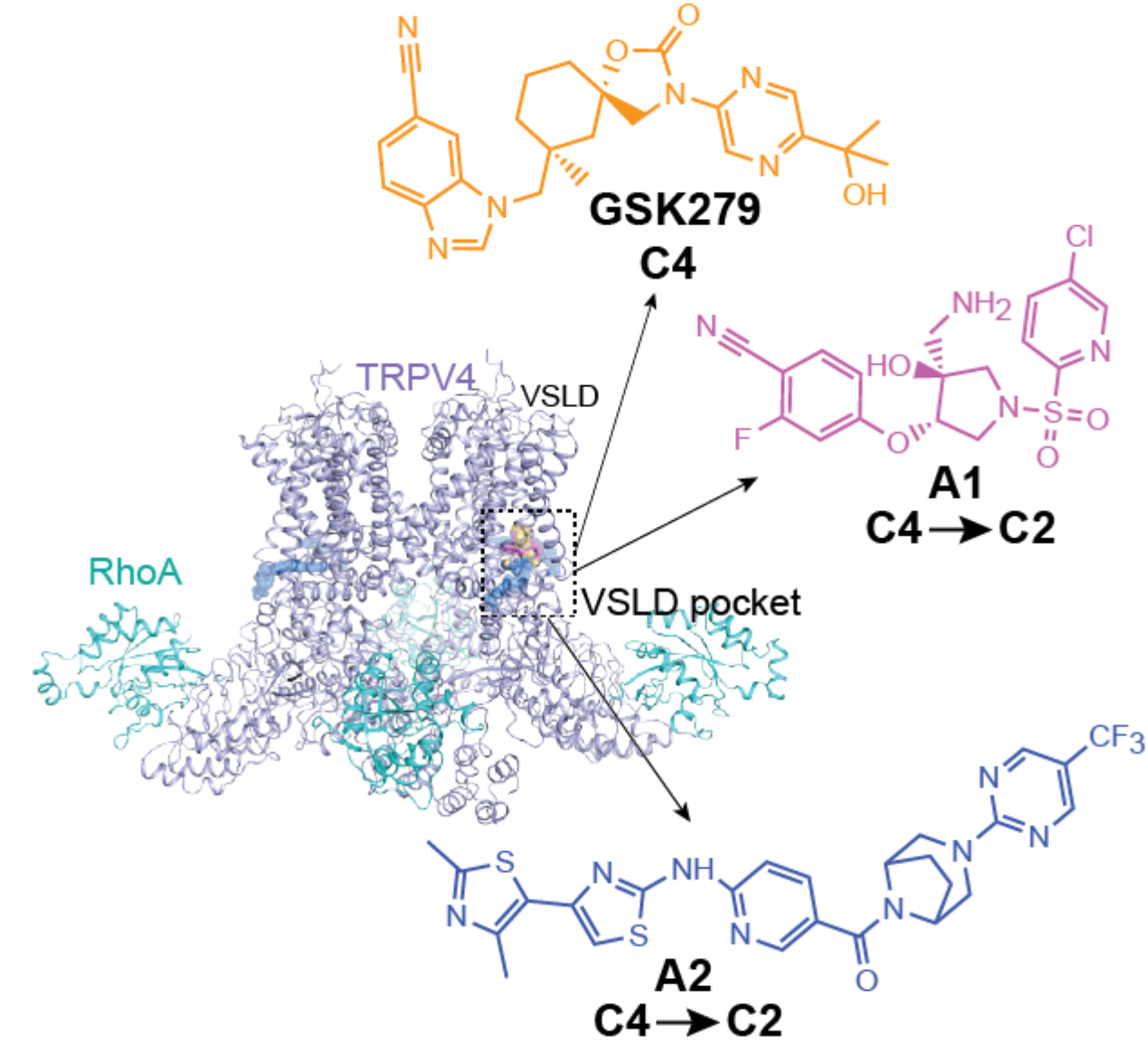
北京分子科学国家研究中心、北大-清华生命科学联合中心雷晓光教授、北京大学医学部药学院黄卓教授以及雷晓光团队副研究员范俊萍博士是论文的共同通讯作者。北京分子科学国家研究中心范俊萍博士、北京大学医学部药学院郭畅博士为该文共同第一作者。阳光安津生物医药公司的廖道红博士、雷晓光课题组博士研究生柯翰、谢文军、博士后唐毓良,以及日本国立生理科学研究所的富勇真琴(Makoto Tominaga)教授和其课题组的雷晶博士为该研究中做出了重要贡献。该研究得到了国家重点研发计划、国家自然科学基金、北京分子科学国家研究中心、北大-清华生命科学联合研究中心、新基石基金会等项目和单位的资助。相关的分子动力学模拟在北京大学高性能计算平台上完成。同时,我们也感谢生物物理所冷冻电镜平台对该研究提供的冷冻电镜支持。
原文链接:http://doi.org/10.1002/advs.202401583