

肖海华课题组在激活抗肿瘤免疫应答的四价铂类纳米药物领域取得新进展
肿瘤免疫抑制微环境是抑制自身抗肿瘤免疫应答、降低抗肿瘤药物疗效、促进肿瘤生长和转移的重要因素。骨髓来源的抑制性细胞(MDSCs)是一种肿瘤内常见的免疫抑制性细胞,它通过抑制细胞毒性T淋巴细胞(CD8+ T细胞)的激活来抑制自身免疫系统对肿瘤的识别和杀伤,从而导致肿瘤的生长和转移。因此,发展一种能够同时抑制MDSCs浸润和促进CD8+ T细胞激活的治疗方案具有重要意义。
在国家自然科学基金委、科技部等项目的支持下,北京分子科学国家研究中心肖海华课题组近年来紧紧围绕生物医用材料和生物安全材料的研究主题,在发展四价铂类纳米药物抗肿瘤研究方向取得了系列进展 (Nat. Biomed. Eng. 2021, 5, 1048; Adv. Mater. 2021, 33, 2100599; Angew. Chem. Int. Ed. 2022, 61, e202201486; Adv. Mater. 2023, 35, 2210267; Angew. Chem. Int. Ed. 2023, 62, e202301074)。
最近,肖海华课题组发展了能够调节肿瘤免疫微环境、促进抗肿瘤免疫应答的四价铂类纳米载药系统。研究人员设计合成了重塑肿瘤免疫微环境的双亲性高分子PolyRA和四价铂前药Oxa-c16,并组装成纳米粒PRA@Oxa-c16。PRA@Oxa-c16通过抑制免疫抑制性MDSCs浸润和激活免疫原性细胞死亡协同高效地激活了CD8+ T细胞,有效地控制了肿瘤的生长。进一步地结合免疫检查点阻断剂α PD-L1抗体,消除了小鼠的皮下肿瘤、抑制了肺转移肿瘤的生长、防止了肿瘤的转移和复发。相关研究成果近期发表在Advanced Materials (2024, DOI: 10.1002/adma.202311640),论文第一作者为博士研究生王斌,通讯作者为肖海华研究员。
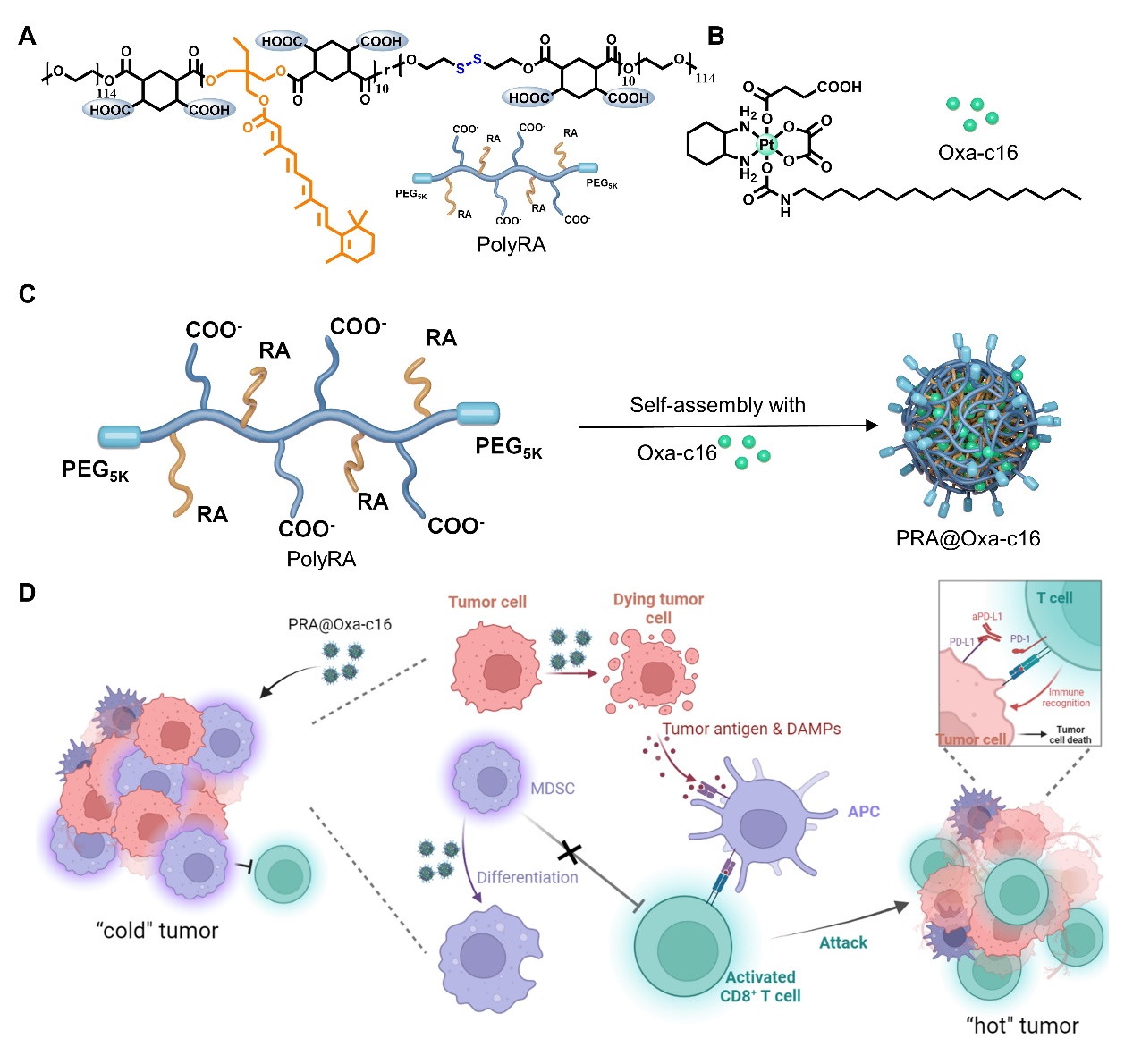
PRA@Oxa-c16 的制备及抗肿瘤示意图