

雷晓光团队合作解析赤霉病抗性基因编码蛋白Fhb7催化机制,开发出高效生物催化降解呕吐毒素新方法
小麦赤霉病被称为小麦“癌症”,是当今农业领域的世界性难题,严重威胁着粮食生产和食品安全。在当今气候变化剧烈的时代下,赤霉病的发生也愈发严峻,给粮食经济带来了越来越严重的损失,使其成为各国政府尤为关注和亟待解决的重大问题。其中,诱导赤霉病发生的禾谷镰刀菌所产生的呕吐毒素(Deoxynivalenol,DON)能够抑制蛋白质的合成,具有严重的毒性,被世界卫生组织定为三级致癌物,给人和动物带来了巨大的粮食安全问题。然而由于DON的结构稳定,使得利用传统物理和化学的方法安全、高效地将其降解极具挑战。
酶因其高效、反应条件温和、环保等多方面的优势,使其受到众多研究者的青睐。虽然目前已有多个能够降解呕吐毒素的酶被发现,但尚未有酶被成功用在实际工业中。并且,目前已发现的所有降解酶都针对DON的3-OH,C9=C10进行氧化、乙酰化、糖基化等修饰实现DON毒性减弱,但是并未有能够转化其主要致毒的C12/C13环氧基团实现DON解毒的酶被发现。直到2020年4月,山东农业大学孔令让教授课题组在Science上报道了在小麦种质资源中可用的主效抗赤霉病基因Fhb7,引发了国际学术和农业界的广泛关注(Science, 2020, 368, eaba5435)。Fhb7编码一种谷胱甘肽转移酶,能够利用谷胱甘肽破坏关键致毒C12/C13环氧基团实现DON的降解,这也是首个被报道的能够破环DON环氧的酶,从而打开了酶法降解呕吐毒素的新思路。然而,针对Fhb7的催化机制、热稳定性等性质尚不清楚,极大地限制了对其工业价值的进一步开发和利用。

图1. 酶法降解呕吐毒素的方式
北京分子科学国家研究中心雷晓光教授团队与北京大学生命科学学院肖俊宇副教授团队合作,首次解析了Fhb7的晶体结构,并且利用结构生物学、氢氘交换质谱、计算化学、生物化学等多学科交叉的手段详细阐明了Fhb7的催化机制。为了解决Fhb7本身热稳定性差的问题,雷晓光教授团队采用定向进化和理性设计的方式对Fhb7进行改造,成功将其Tm值提升15℃,半衰期(t1/2)延长近270倍,从而极大提升了其实际应用价值。最后,利用获得的优良突变体,对饲料工业中允许使用的枯草芽孢杆菌进行菌株改造,实现了Fhb7在其中的成功表达和对DON的高效降解。该研究解决了将Fhb7用于饲料工业的热稳定性问题,同时提出了利用合成生物学的手段构建工程有益菌,实现工业上降解呕吐毒素的新思路。此外,也为利用合成生物学手段实现使用一种工程菌同时降解多种霉菌毒素奠定了坚实的研究方向和策略。
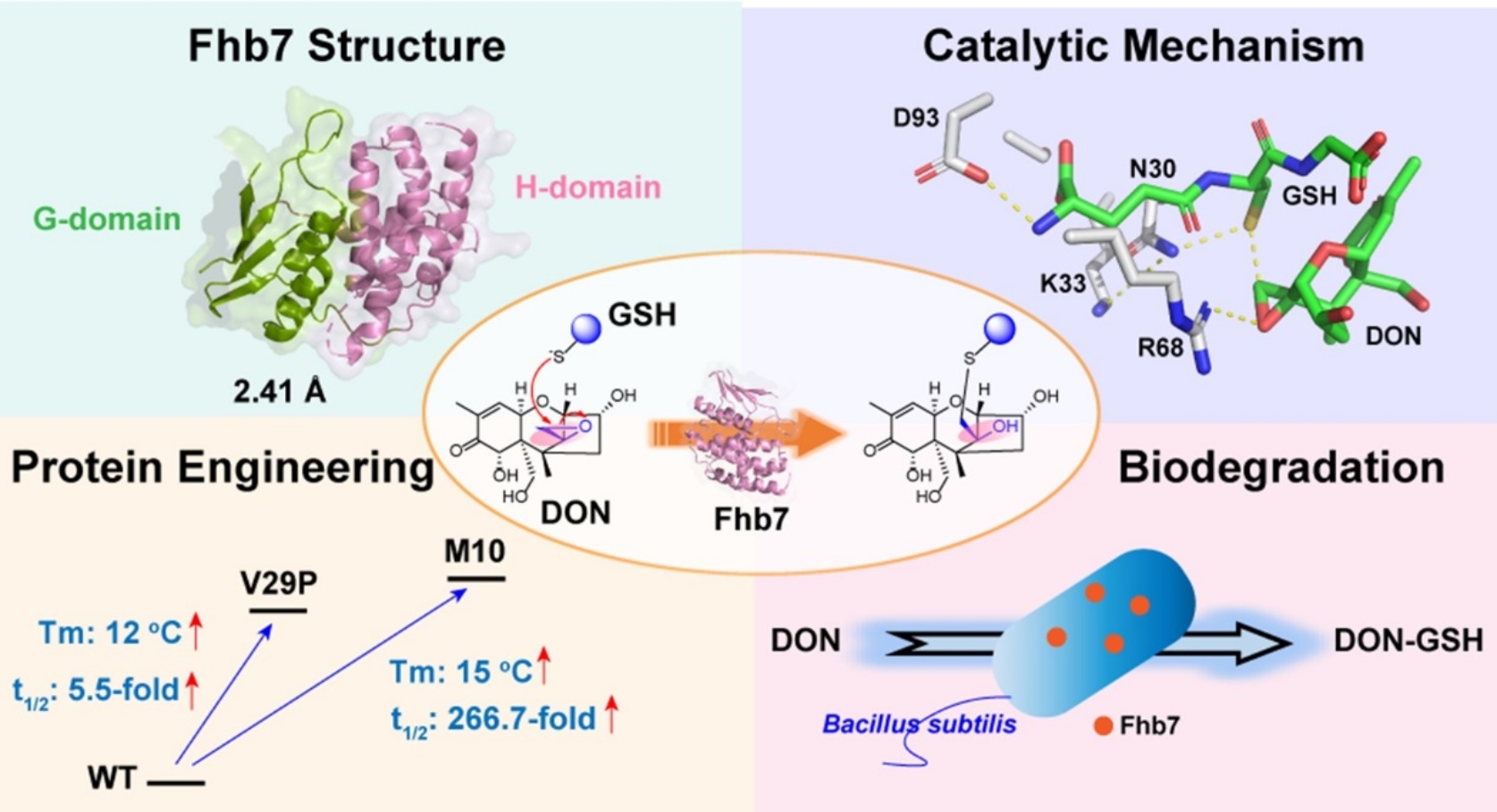
图2. Fhb7催化机制、改造和应用
该工作以“Enzymatic degradation of deoxynivalenol with the engineered detoxification enzyme Fhb7”为题发表在国际权威期刊《美国化学会志-开放获取期刊》《JACS Au》上(DOI: 10.1021/jacsau.3c00696)。
北京分子科学国家研究中心雷晓光教授与北京大学肖俊宇副教授为论文的共同通讯作者,雷晓光课题组博士研究生杨军、肖俊宇课题组博士后梁凯博士为该论文的共同第一作者。雷晓光课题组博士研究生柯瀚、大连化物所张跃斌博士、上海药物研究所孟乾博士、雷晓光课题组高磊和范俊萍副研究员也参与了相关研究工作。大连化物所李国辉研究员以及上海药物研究所周虎研究员为该研究提出了重要指导。该研究得到了国家重点研发计划、国家自然科学基金委员会、北京分子科学国家研究中心、北大-清华生命科学联合研究中心、北京市“卓越青年科学家计划”、新基石基金会科学探索奖等项目和单位的资助。
《JACS Au》原文链接:Enzymatic degradation of deoxynivalenol with the engineered detoxification enzyme Fhb7