化学生物学研究部刘志博课题组报道放疗驱动的活体剪切化学
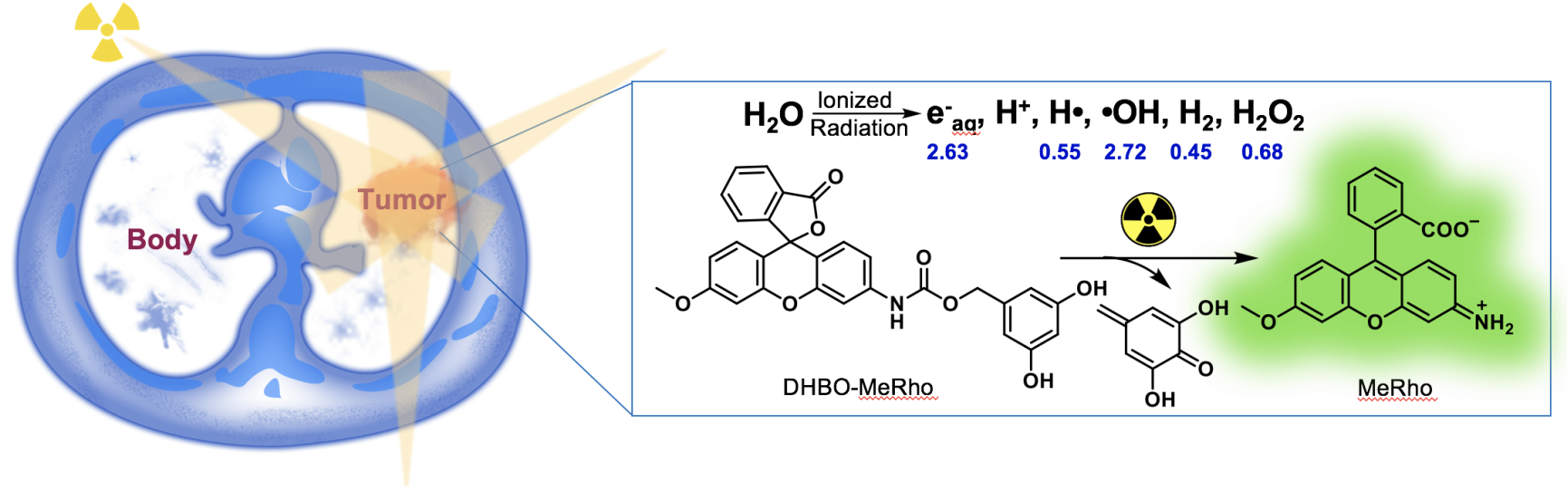
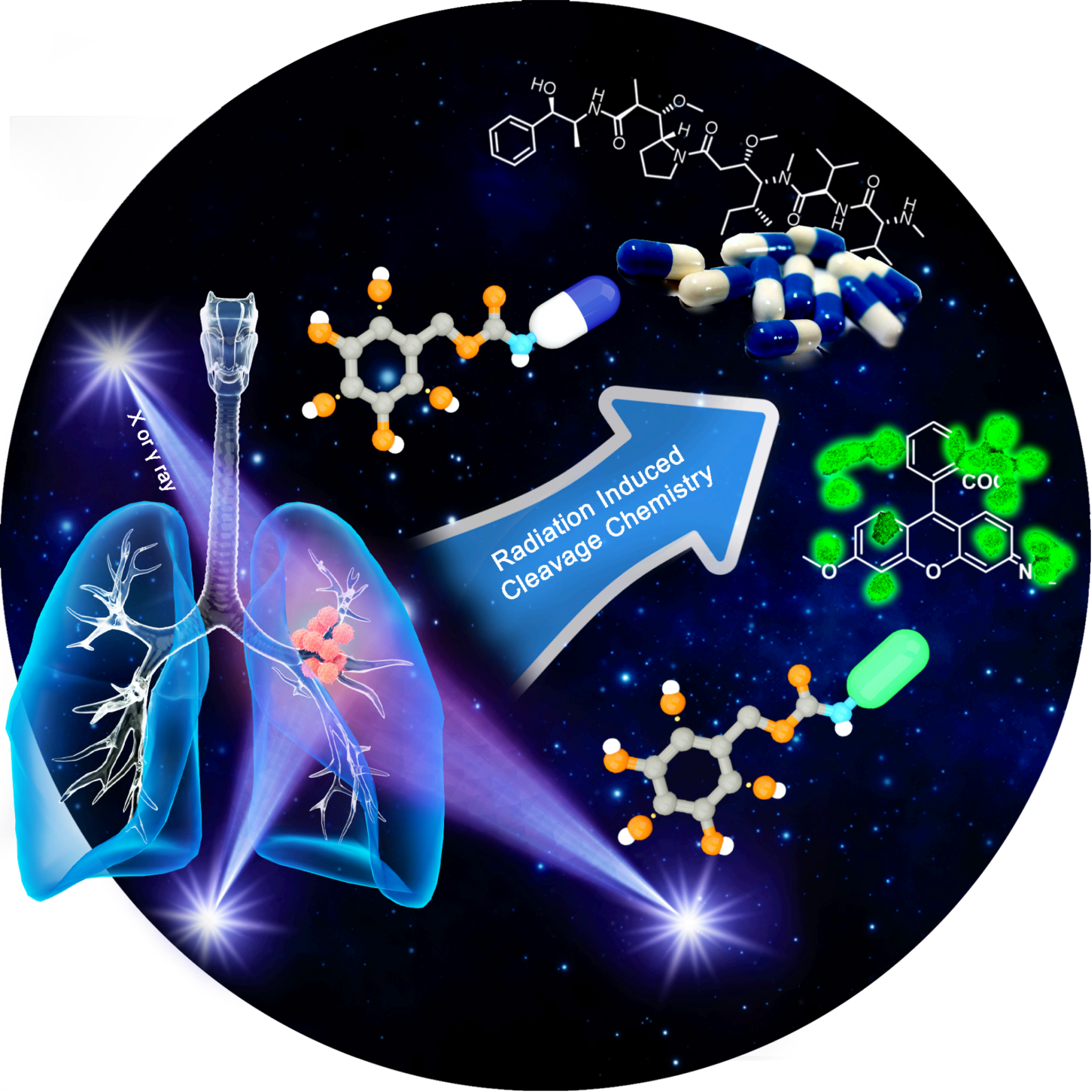
近来,主动激活的活体剪切化学发展迅速,但也遇到诸多困难。主流的活体剪切反应主要基于小分子激活剂、紫外光及可见光等。相比于小分子激活,光激活策略具备高时间空间分辨率的优势,但也存在穿透深度不足的问题,难以运用于组织深层。而X射线等外源辐射则没有组织穿透力的局限,同时随着三维放疗等现代放疗技术的发展,其空间分辨率可达亚毫米甚至微米级别。刘志博课题组致力于发展新型活体可控释放化学,并取得若干原创性成果。
在该文中,刘志博课题组率先报道了核辐射驱动的活体剪切化学,基于放射性穿透力强、时空分辨率高的优势,核辐射激活有望精确调控体内化学键的断裂,弥补光激活手段的不足,实现核辐射驱动的活体干预(Radiation-Activated Perturbing, RAP)。与其他激活手段相比,该策略具有:1)高时空分辨率;2)高组织穿透能力;3)高临床相关性。作为一类辐射引发的可控释放策略,RAP策略有着明确的临床应用价值。目前,有近一半的癌症患者需接受放疗。单纯接受放疗癌症易复发,预后差,通常需要与化疗相结合。但传统化疗药物效果往往不理想,毒副作用强。基于RAP策略借助外源辐射激活体内化疗前药,有望实现肿瘤特异的可控药物释放,发展放疗引导的肿瘤精准化疗。