

化学生物学研究部张俊龙课题组与合作者利用“协同”策略构筑金属药物治疗脑卒中

图一. 研究策略
在长期模拟天然多核金属酶结构的基础上(Adv. Synth. Catal., 2012, 354, 1529; Dalton Trans., 2013, 42, 5390; Chin. Chem. Lett., 2015, 26, 937;Inorganics., 2018, 6, 20),张俊龙课题组积极探寻金属仿酶小分子的生物医学应用。他们发现在具有C3-对称性的分立式三核锰化合物中,过氧化氢(H2O2) 体外分解速率相对于单核化合物大大提高(6-7倍),同时产生羟基自由基的副反应(Fenton反应)几乎被完全抑制。他们与高松课题组合作进行了中间体(自由基和顺磁物种)的捕捉和表征,提出金属-金属的协同作用加快过氧化氢分解(均裂)的机理。如图一所示,中间体Mn=O的空间结构可能协助过氧化氢的质子吸收(proton absorb),形成无害的氧气分子。

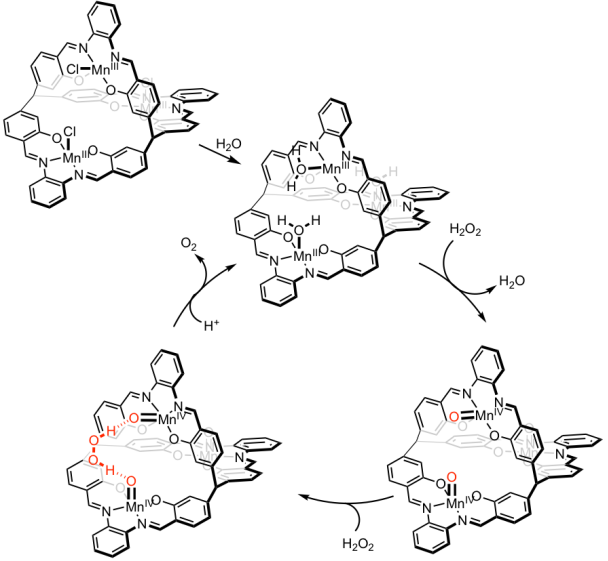
a) b)
图二. a)催化过氧化氢分解的相关产物、中间体的表征及 b)推测的协同机理。
为了进一步验证协同作用在金属药物设计中的应用,他们与北京大学第一医院康磊课题组和美国德州大学奥斯汀分校的Jonathan Sessler课题组合作,模拟临床动脉阻塞引起的脑缺血。在大鼠脑缺血再灌注模型(MACAO)中,锰单核和三核化合物实现对脑组织的抗氧化保护,给药后行为障碍(追尾现象)明显改善,脑组织受损体积显著减小。通过神经行为学评分、FDG脑显像、病理切片染色(TTC,HE,TUNEL,IHC)等手段评价了化合物的治疗效果,表明三核化合物给药后的治疗效果相对单核化合物显著增加。另外,由于锰化合物也被广泛研究作为造影剂应用于核磁共振成像,这为“影像介导治疗”提供了可能。免疫组化结果显示,三核锰化合物治疗后缺血皮质中caspase-3 和Bax的水平显著降低,表现出神经保护作用。
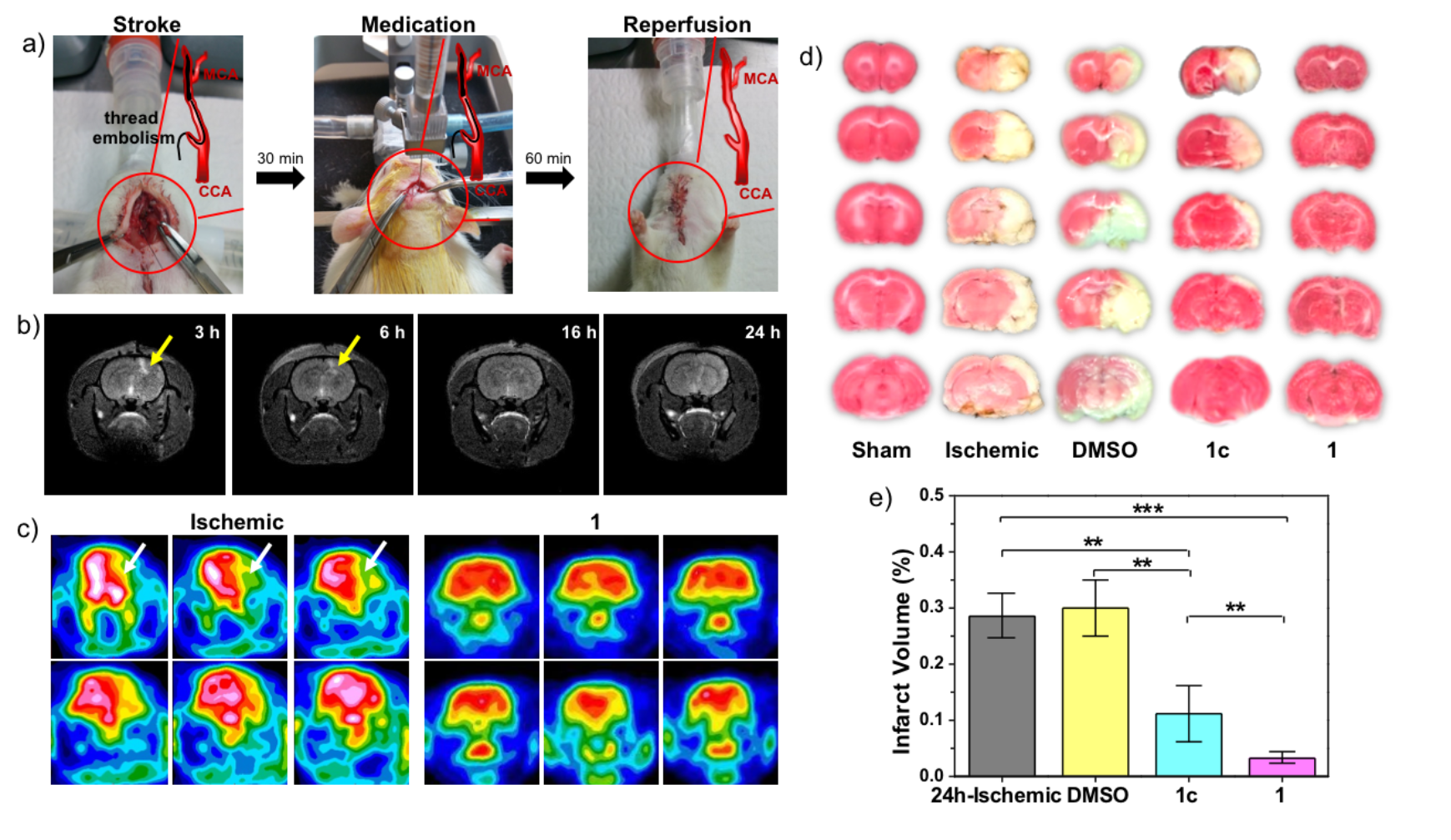
图三. a)大鼠MACAO模型的手术示意图;b)颅内注射三核化合物后不同时间点的脑磁共振成像图;c)手术对照组与三核化合物治疗组的FDG脑显像结果;d)健康对照组、手术对照组、DMSO组、三核或单核化合物治疗组的TTC染色结果,其中白色区域为缺血受损区域;e)手术对照组、DMSO组、三核或单核化合物治疗组的脑组织受损体积。
该研究工作为金属仿酶化学(Biomimetic Inorganic Chemistry)提供研究新范式,发掘金属仿酶小分子在疾病的治疗和诊断中的潜在用途,也为金属药物的设计提供了新思路。宁莹莹博士为该论文的第一作者。张俊龙、康磊和Jonathan Sessler教授为共同通讯作者。合作者还包括高松院士、王炳武和蒋尚达等老师。近期,ChemistryViews.org网站以“Manganese Complex Protects against H2O2-Induced Stroke Damage”为题推介该工作。https://www.chemistryviews.org/details/news/11243277/Manganese_Complex_Protects_against_H2O2-Induced_Stroke_Damage.html。该研究得到了国家自然科学基金委员会、科技部以及北京分子科学国家研究中心的经费支持。