2020年4月27日,化学生物学研究部贾桂芳该课题组在Nature子刊《Nature Chemical Biology》在线发表了题为“Antibody-free enzyme-assisted chemical approach for detection of N6-methyladenosin”的研究论文,首次报道了利用FTO酶辅助实现了RNA修饰m6A的化学标记,并成功应用于全转录组m6A的高通量测序。
随着首个RNA修饰N6-甲基腺嘌呤(m6A)的去修饰酶FTO的发现,RNA表观遗传学/表观转录组学开始兴起并成为表观遗传学新的研究热点。m6A作为首个被发现的可逆RNA修饰,广泛存在于mRNA,依赖修饰酶、去修饰酶和结合蛋白发挥调控功能。已发现m6A具有调控mRNA剪接、出核、稳定性和蛋白翻译等功能,可以参与发育、配子发生、细胞重编程、生物节律、疾病等多种生理和病理过程的功能调控。为了更好地研究m6A生物功能和临床病理研究,开发m6A高通量测序技术一直是研究的热点。
现有m6A测序技术主要依赖于m6A抗体富集技术,包括低分辨率的m6A-seq/MeRIP-seq和联用iCLIP或PAR-CLIP技术的高分辨率m6A测序技术miCLIP 或PA-m6A-seq。抗体存在对特定RNA序列或结构的潜在非特异性结合,为了解决抗体方法的种种问题,研究者们做出了各种尝试,近期开发了两类无需抗体的m6A测序技术,一类为利用对特定甲基化序列(m6ACA)敏感的RNA核酸内切酶MazF辅助的测序方法(m6A-REF-seq or MAZTER-seq),此类方法只能检测16~25%的m6A位点;另一种是在细胞内表达融合m6A-binding domain(YTH)与胞嘧啶脱氨酶(APOBEC1)的融合蛋白实现的m6A测序(DART-seq),但该方法依赖于细胞转染效率且受限于体外样品的使用。
贾桂芳课题组一直致力于开发和利用核酸化学生物学技术研究RNA化学修饰在动植物中的生物功能研究。在本课题中,贾桂芳课题组巧妙地利用m6A的去甲基酶FTO蛋白作为催化剂,将mRNA上化学惰性的m6A转化为高反应活性的中间态产物N6-羟甲基腺嘌呤(hm6A),然后利用二硫苏糖醇(DTT)的巯基与hm6A发生亚胺1,2加成反应,将不稳定的hm6A转化为更稳定的巯基加成产物dm6A。dm6A上的自由巯基可以与甲烷硫代磺酸(methanethiosulfonate,MTSEA)快速反应,实现在mRNA上m6A的位置标记生物素Biotin,最终可被链霉亲和素珠捕获,从而富集含有m6A修饰的RNA片段供后续高通量测序使用。此方法被命名为m6A-SEAL(FTO-assisted m6A selective chemical labeling method)(见图一)。
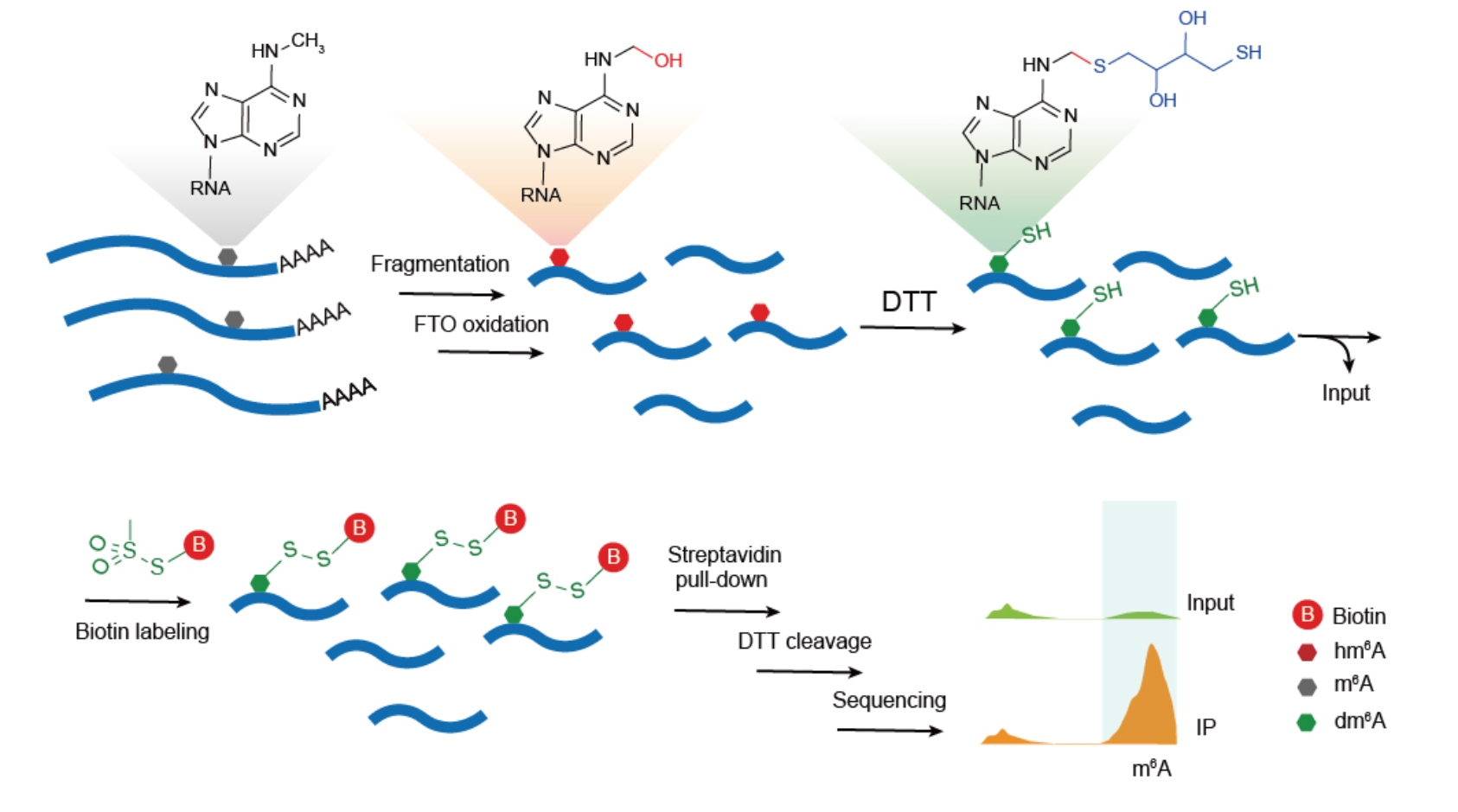
图一. m6A-SEAL测序流程图
他们将m6A-SEAL分别应用于人HEK293T细胞和水稻的polyA+ RNA上,实现全转录组m6A位点检测。通过该课题组之前开发的基于qPCR的m6A单位点检测方法SELECT验证了多个m6A位点,证明m6A-SEAL作为化学共价交联技术,要比基于抗体的方法或DART-seq具有更高的可靠性和灵敏度。FTO除m6A外,还对RNA5’帽位置的N6,2'-O-二甲基腺嘌呤 (cap m6Am)具有催化活性,能将其催化为hm6Am。为了验证m6A-SEAL测序方法是否还会同时检测cap m6Am,他们通过体外酶活性实验和标记实验发现目前m6A-SEAL方法中使用的FTO氧化反应条件只能特异性将m6A反应成hm6A,通过优化FTO氧化反应条件可以实现m6A-SEAL只针对cap m6Am的标记和测序。
总之,该项研究首次利用FTO酶辅助实现了RNA修饰m6A化学标记和高通量测序。m6A-SEAL具有高灵敏度和高特异性的特点,可以应用于少量mRNA样品。未来他们将继续对m6A-SEAL进行优化和改造,以实现单碱基分辨率。由于FTO可以氧化催化RNA的cap m6Am和DNA的N6-甲基脱氧腺嘌呤(6mA),未来m6A-SEAL通过优化有望应用于这些化学修饰的测序;同时该方法除了可以在m6A上标记biotin用于富集,还可以标记荧光素,有潜力应用于m6A的成像。
贾桂芳实验室已毕业的博士研究生王烨为论文的第一作者,已毕业的博士研究生肖雨、博士后喻琼和本科生董舜卿为共同作者,贾桂芳研究员为通讯作者。原文链接: https://www.nature.com/articles/s41589-020-0525-x


