2020年3月11日,分子动态学于激发态化学研究部刘志博课题组和北京生命科学研究所邵峰实验室合作在Nature杂志在线发表文章。在前期工作中,刘志博实验室发现一类含硼氨基酸探针(18F-硼氨酸)在肿瘤上有显著且特异的摄取,并将其用于临床中脑瘤的早期诊断和精确划界。在该项研究中,研究人员发现硼氨酸上的三氟化硼基团可直接用于硅烷(silyl ether)的脱除反应。在此基础上,研究人员在细胞以及活体水平上构建了苯丙硼氨酸(Phe-BF3)介导的生物正交剪切系统,赋予硼氨酸探针激活功能,并通过“双靶向激活”策略实现了肿瘤选择性的蛋白功能调控。该系统具有普适性,但对于需要在肿瘤细胞内选择性释放的蛋白更具优势,而Gasdermin蛋白就是一个范例。邵峰实验室近年研究发现Gasdermin家族蛋白是细胞焦亡的执行分子。Gasdermin蛋白在细胞内被激活后,其N端结构域在细胞膜上寡聚成孔,最终导致细胞裂解性死亡,诱导强烈的炎症反应。研究人员将该生物正交系统应用到Gasdermin蛋白后,实现了肿瘤原位且可控性地激活细胞焦亡。进一步研究发现,在肿瘤中引发细胞焦亡可诱导机体高效的抗肿瘤免疫活性进而清除肿瘤。
在活体内实现肿瘤选择性的蛋白功能调控,对生命科学研究和临床药物开发都有着非常重要的意义,但目前仍是化学生物学领域一个长期存在的挑战。该研究工作一方面展现了基于三氟化硼脱硅反应的“双靶向激活”策略效率高、生物正交性好的优势,揭示了将探针改造为激活剂(Probing-to-Perturbing)这一设想在活体蛋白激活上的巨大潜力。利用这个新颖的生物正交技术,该研究揭示少部分的肿瘤细胞发生焦亡,就足以有效调节肿瘤免疫微环境,进而激活很强的T细胞介导的抗肿瘤免疫反应,该发现为肿瘤免疫治疗药物研发提供了新的思路,Gasdermin家族蛋白也成为潜在的肿瘤免疫治疗的生物标志物,这类蛋白的激动剂则很有可能成为抗肿瘤药物研发的新方向。
刘志博课题组的博士生王钦阳和邵峰课题组的博士后王玉鹏是该论文的共同第一作者,其他作者还包括中科院生物物理所的丁璟珒博士,刘志博课题组的研究生王春洪和交流生周雪涵,邵峰实验室的研究生高文清和黄焕伟,刘志博博士和北京生命科学研究所邵峰博士是该论文的共同通讯作者。原文链接:https://www.nature.com/articles/s41586-020-2079-1
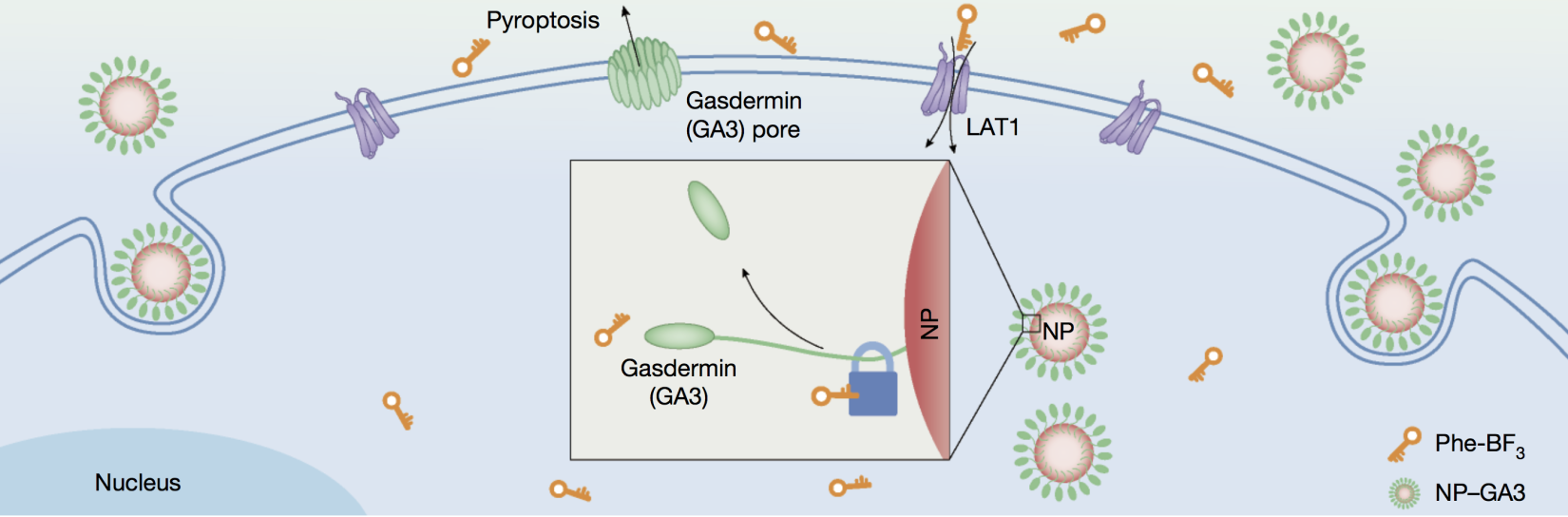
图一 硼氨酸介导的生物正交剪切系统在细胞内可控释放Gasdermin蛋白示意图。
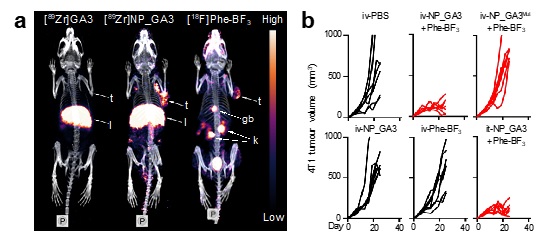
图二 a) PET-CT分子影像在活体内示踪“双靶向”生物正交剪切系统。
b) 硼氨酸介导的生物正交剪切系统可在肿瘤内选择性释放Gasdermin焦亡蛋白,在动物模型上显著抑制肿瘤生长。



