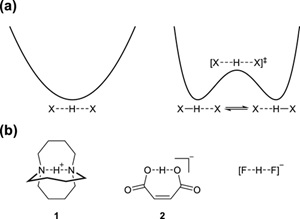
氢键在物理、化学、生命科学和材料科学等自然科学中的重要性不言而喻。科学家在研究氢键的时候经常会涉及到氢键对称性的问题。在对称氢键中,质子处于两个相同的离子、分子或分子片的正中央,势能面上仅存在一个势阱(图1a;左)。对于非对称X?H···X氢键,双势阱势能面中的对称结构为过渡态(图1a;右)。图1b中给出了一些对称氢键的例子:对称N···H···N氢键存在于质子化1,6-二氮杂双环[4.4.4]十四烷(1)中;对称O···H···O氢键存在于马来酸氢盐(2)中;对称F···H···F氢键存在于氟氢化物中。考虑到C与N、O、F同周期且其电负性比H强,从理论上讲,对称C···H···C氢键也是有可能存在的。但是,文献中却鲜有关于对称C···H···C氢键的实验或理论研究。
图1.(a)氢键的对称性;(b)对称氢键示例。
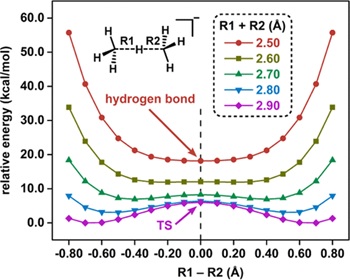
最近,合成与组装化学研究部余志祥教授和研究助理王熠博士通过理论计算首次提出了对称C···H···C氢键存在的可能性。作者首先以甲烷与甲基负离子所形成的氢键复合物为例论证了对称C···H···C氢键存在的理论基础。如图2所示,当两个碳原子之间的距离被固定为2.90 ?时,体系展现出了双势阱势能面的特征。随着两个碳原子不断靠近,势能面逐渐由双势阱向单势阱过渡。最终,当两个碳原子之间的距离被缩短至2.50 ?时,体系中首次出现了对称的碳氢碳氢键。
图2. 势能面扫描。
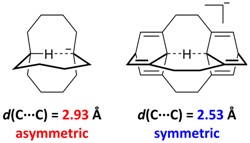
然而,在上述例子中具有对称氢键的结构并不是体系的能量极小点。因此,接下来他们开始着手于利用理论计算设计一些更加合理的对称C···H···C氢键。为了将两个碳原子之间的距离固定在2.5 ?附近,作者参考了质子化1,6-二氮杂双环[4.4.4]十四烷(1;其结构如图1b所示)中的对称N···H···N氢键。在该结构中,两个氮原子之间的距离为2.53 ?。他们试图通过设计分子内C···H···C氢键,并利用环张力强迫两个碳原子靠近(图3;左)。但是,这一策略并未取得成功。经过几何优化,作者发现体系能量极小点中的C?H···C氢键是非对称的,且两个碳原子之间的距离长达2.93 ?。为了进一步缩短两个碳原子之间的距离,作者通过引入笼状结构(例如桶烯)进一步增加了体系的环张力。如图3(右)所示,此时体系能量极小点中两个碳原子之间的距离仅为2.53 ?,且C···H···C氢键是对称的。至此,作者成功例证了对称C···H···C氢键存在的可能性。
图3. 非对称C?H···C氢键(左)和对称C···H···C氢键(右)。
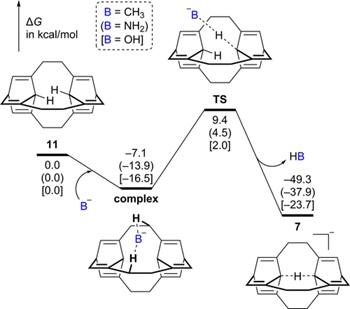
最后,作者对合成该碳负离子的途径进行了理论研究。如图4所示,由烃类前体11到目标碳负离子7的转化在热力学上是可行的。这意味着(至少在气相中)烃类前体11具有比水分子更强的酸性。同时,这些反应的活化能均不高(小于20 kcal/mol),这意味着目标碳负离子7有机会在较为温和的反应条件下被合成出来。基于这些正面的初步结果,作者期望合成化学家能够在不久的将来设计出更加合理的反应前体,并在实验上成功实现对称C···H···C氢键的构筑。该工作发表在J. Org. Chem. 2020, 85, 397。 以上工作在X-Mol上也有相关介绍(https://www.x-mol.com/news/158535)。
图4. 由烃类前体11转化为碳负离子7的势能面。