

合成与组装化学研究部在Nature Reviews Chemistry杂志综述ATP合酶体外重组方面进展
以天然生物活性分子为基元,利用分子组装策略构建新型的仿生体系,模拟生命基本单元的结构与功能,能有助于在分子层面上理解与认知生物活动的本质与物理化学机制,已发展成为组装生物学的研究新方向。
ATP合酶是自然界中最小的生物分子马达,在生物能的产生和转化方面起着关键作用。生命活动所必需的能量三磷酸腺苷(ATP)就是由ATP合酶在跨膜质子梯度势的推动下合成。
在国家自然科学基金委、科技部和中国科学院的支持下,合成与组装化学研究部李峻柏课题组长期致力于生物分子马达ATP合酶的分子组装与应用研究,十余年来取得了系列重要进展。2007年该研究团队首次将活性马达蛋白ATP合酶重组在类细胞结构的微胶囊上,实现了ATP合酶在组装体上功能的体外模拟(Angew. Chem. Int. Ed., 2007, 46, 6996; Adv. Mater., 2008, 20, 601; Adv. Mater., 2008, 20, 2933)。随后该研究团队将ATP合酶分别与纳米酶、光系统II、人工光酸分子或量子点等功能组分进行共组装,实现了体外有效模拟线粒体的结构与功能,以及叶绿体中光合作用过程,并大幅度提升了光合磷酸化效率,为有效利用光能提供了新途径(ACS Nano, 2016, 10, 556; Angew. Chem. Int. Ed., 2017, 56, 12903; ACS Nano, 2018, 12, 1455; Adv. Funct. Mater., 2018, 28, 1706557; Angew. Chem. Int. Ed., 2018, 57, 6532; Angew. Chem. Int. Ed., 2019, 58, 796; Angew. Chem. Int. Ed., 2019, 58, 1110; Angew. Chem. Int. Ed., 2019, 58, 5572)。
鉴于该课题组在ATP合酶体外重组方面多年来的原创性和系统性研究,最近应《Nature Reviews Chemistry》主编邀请撰写综述,并指出该课题组在国际上引领(as leader in this field worldwide)相关领域的研究。综述论文发表在最新一期 Nat. Rev. Chem. (2019, 3, 361-374)杂志上。
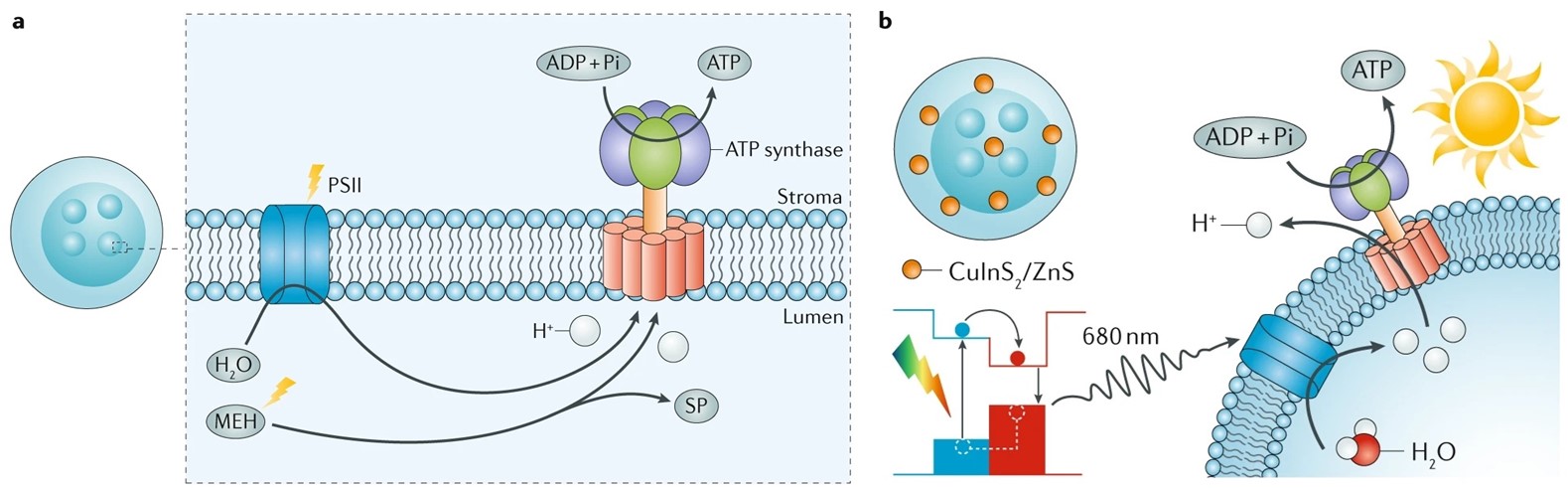
ATP合酶、光系统II与(a)光酸分子、(b)量子点共组装用于增强光合磷酸化